- 1
- 1°F
- 1°F PORT
- 1ª série A
- 1ª série B
- 1ª série C
- 1ª série D
- 1ª série E
- 1ª série F
- 1F
- 2 série A
- 2° Série E
- 2°A tecnologia
- 2°B
- 2°B TECNOLOGIA
- 2°C
- 2°D
- 2°D TECNOLOGIA
- 2ª série B
- 2ª Série C
- 2ª série D
- 2ª série E
- 2C
- 3ª série A
- 3ª série B
- 3ª série C
- 3ª série D
- 6° E 7° ANOS ELETIVAS CULTURA REGIONAL. PROFESSORA ANA PAULA
- 6º ano A
- 6º ano B
- 6º ano C
- 7 A
- 7A
- 7c
- 7º ano A
- 7º ano B
- 7º ano C
- 7ºB
- 7ºC
- 8 B
- 8° e 9° anos eletivas oficina ortográfia
- 8º
- 8º A
- 8º ano A
- 8º ano A 8º ano B
- 8º ano B
- 8º ano C
- 8º B
- 8º B C
- 8º C
- 8º e 9º Ano.
- 9º ano A
- 9º ano B
- AAPs - EF - 6º 7º 8º e 9º Anos EM - 1º 2º e 3º
- Avisos Coordenação
- B
- C
- D
- Direção
- Eletiva Áudio Visual
- ELETIVA BIBLIOTECA
- Eletiva Cultura Regional 6º e 7º anos
- Eletiva de Biblioteconomia - Ensino Médio
- Eletiva de Cinema - Ensino Médio
- Eletiva de Eventos - Ensino Médio
- Eletiva de Fotografia - 8º e 9º anos
- Eletiva de Ortografia - 8º e 9º anos
- Eletiva de Reciclagem/Revitalização - 6º e 7º anos
- Eletiva de Teatro - Ensino Médio
- Eletiva de Técnicas de Redação para o Enem - Ensino Médio
- Eletiva Empreendedorismo - 8º e 9º anos
- Eletiva Feminícidio - Ensino Médio
- Eletiva Laboratório de Matemática - 8º e 9º anos
- Eletiva Laboratório de Matemática - Ensino Médio
- Eletiva Quadrinho - HQ - Ensino Médio
- Eletiva turismo
- Grêmio Estudantil
- PROFESSORA: DEBORAH
- PROFESSORA: MARIA MARLI
- PROFESSORA: MARIA MARLI 3º
- PROFESSORA: MARIA MARLI DE HISTÓRIA 7ºB
- PROFESSORA: MARIA MARLI- 1º
- PROFESSORA:DEBORAH
- PROFESSORA:MARIA MARLI
- Projeto de Vida Protagonismo Juvenil
quarta-feira, 9 de setembro de 2020
Prof. José Luis - Geografia - 9º Anos A e B - 3º Bimestre
Ler as paginas 20 e 21 e responder os exercicios.
Entrega até 16 de setembro
E-mail: porto_2170@yahoo.com.br
Prof. José Luis - Geografia - 1º Anos A, B, C, D, E, e F - 3º Bimestre
Fazer os exercícios das páginas 50 e 51
Tema: Estrutura e firmas do planeta terra.
Ler as páginas 49 50 e 51
Pode mandar no email ou no zap particular
Entrega até 16 de setembro
e-mail: porto_2170@yahoo.com.br
Prof. José Luis - Geografia - 2º Anos A, B, C e D - 3º Bimestre
Tema. Dinâmicas demográficas matrizes culturais do Brasil.
Ler as páginas 54, 55, 56 e 57
Fazer os exercicios das pags. 55, 56 e 57
Pode mandar no email ou no zap particular
Entregar até 16 de setembro
e-mail: Porto_2170@yahoo.com.br
3º Ano A e 3° Ano B - Biologia - Profa Solange
Período para entrega: Até 16/09/2020
Unidade Temática: Origem da Vida
Instruções:
1- Fazer a leitura e interpretação de texto.
2- Assistir as vídeo aulas (Khan Academy), links disponibilizados abaixo, digitar no Google USP Talks, assistir o vídeo sobre As Origens da Vida e do Universo.
3- Responder as questões disponibilizadas logo abaixo do texto.
4- Postar no Blogger e enviar para o e-mail da professora: solangestandbyme@gmail.com
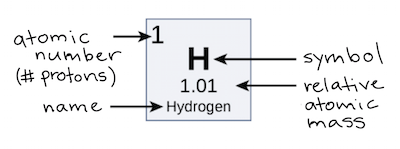
Número atômico, massa atômica e isótopos
Introdução
Número atômico, massa atômica e massa atômica relativa
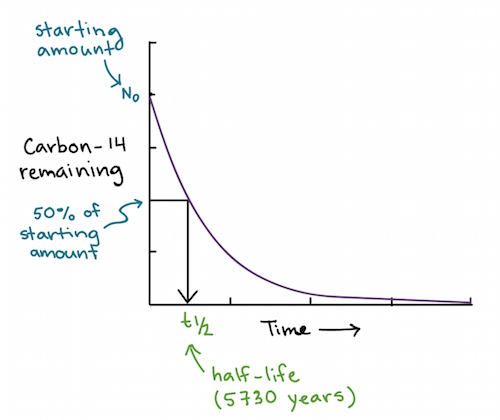
Isótopos e decaimento radioativo
Créditos:
- "Atoms, isotopes, ions, and molecules: the building clocks" by OpenStax College, Biology (CC BY 3.0). Baixe gratuitamente o artigo original de http://cnx.org/contents/185cbf87-c72e-48f5-b51e-f14f21b5eabd@9.87:6/Atoms-Isotopes-Ions-and-Molecu.
- "Studying the history of life" by CK-12 Foundation, found in CK-12 Biology I – Honors (CC BY-NC 3.0). Baixe gratuitamente o artigo original de http://www.ck12.org/book/CK-12-Biology-I-Honors-CA-DTI3/section/11.1/.
Referências:
- "Isotopes of Carbon." Wikipedia. September 8, 2015. Acessado em 4 de outubro, 2015. https://en.wikipedia.org/wiki/Isotopes_of_carbon.
- Reece, J. B., L. A. Urry, M. L. Cain, S. A. Wasserman, P. V. Minorsky, and R. B. Jackson. "Calibrating a Standard Radioactive Isotope Decay Curve and Interpreting Data." In Campbell Biology, 28-43. 10th ed. San Francisco, CA: Pearson, 2011.
Outras referências
Exercícios de Aprendizagem:
1- Analise as alternativas abaixo e marque aquela que indica corretamente o nome da teoria que defende que a vida surgiu no planeta a partir de organismos provenientes de outras partes do universo.
a) Abiogênese.
b) Geração espontânea.
c) Evolução química.
d) Panspermia.
e) Seleção natural.
2- A origem da vida é explicada por diferentes teorias. Em uma delas, sugere-se que a vida surgiu devido à presença de gases na atmosfera que sofreram a ação de descargas elétricas e radiações, fazendo com que moléculas inorgânicas dessem origem a moléculas orgânicas. Essa ideia é conhecida como
a) Abiogênese.
b) Geração espontânea.
c) Evolução química.
d) Panspermia.
e) Seleção natural.
3- A origem da vida sempre foi motivo de muita pesquisa e dúvidas. Inicialmente, acreditava-se que a vida surgia a partir de matéria inanimada, uma teoria conhecida como
a) Biogênese.
b) Geração espontânea.
c) Evolução química.
d) Evolução molecular.
e) Seleção natural.
4- (Unicentro) São muitas as discussões sobre a origem da vida no planeta Terra. Os estudos sobre o assunto evidenciam a importância dos avanços tecnológicos e das pesquisas para o aprimoramento das hipóteses sobre a origem da vida. Porém, após alguns séculos de estudos, apesar de consideráveis avanços, ainda existem muitas perguntas sem respostas. Sobre as principais teorias da origem da vida, pode-se afirmar:
a) Haldane e Oparin admitiam que moléculas inorgânicas, encontradas na atmosfera primitiva, se combinariam originando moléculas orgânicas simples, que, posteriormente, adquiriram a capacidade de autoduplicação e metabolismo.
b) A teoria da abiogênese foi confirmada com as pesquisas realizadas por Pasteur, em que micro-organismos foram encontrados em frascos com “pescoço de cisne”, após o processo de fervura.
c) Os avanços tecnológicos e as pesquisas atuais permitiram definir a descoberta da vida como sendo através da evolução de componentes inorgânicos originados no próprio planeta Terra.
d) Segundo a panspermia, os primeiros seres vivos teriam vindo do cosmos e seriam pluricelulares e autótrofos.
e) As pesquisas realizadas puderam comprovar a hipótese autotrófica, pois não existiam nutrientes suficientes na Terra primitiva para suprir os seres vivos.
5- (UCPel) O aglomerado de moléculas orgânicas, revestido por uma película de moléculas de água e que, na opinião de alguns cientistas, pode ser um dos primeiros passos rumo à origem da vida, chama-se:
a) Aminoácido.
b) Coacervado.
c) Micro-organismo.
d) Enzima.
d) Proteína.
Professor Cristiano - Filosofia - 1º A - Retomada de conteúdos 2º Bimestre
Código da Turma: lvftdlk
Texto: Impossível não ser.
Atividade - Retomada de Conteúdos
Professor Alex Educação Física 3º Bimestre 7ºs A e B
Lista de atividades pedidas para o 3º Bimestre de 2020
Atividade 1 Esporte de precisão: ‘Bocha’
Data: 13/08
Entrega: 21/08
Dê outras sugestões de adaptação de materiais e campo de
jogo. Descreva da seguinte forma:
·
Materiais
o
Bolas
o
Pista
·
Regras no mesmo formato das regras acima, tem
adaptações ou variações.
Atividade 2 – SP Faz Escola Vol 3
7ºs anos - Educação Física
PRAZO DE ENTREGA: 11/09/2020
sexta-feira
Págs. 51 até 53
Atividade 1 – O que você já sabe?
Sondagem dos conhecimentos prévios sobre Ginástica, mais
especificamente G.R (Ginástica Rítmica) – relatos pessoais, não tem resposta
certa.
Atividade 2 – Curiosidade sobre a G.R.
Atividade comentada na aula do CMSP de 06 de agosto,
interpretação de texto.
Arregacem as mangas e BONS ESTUDOS!!
Professor Alex
Professor Alex Educação Física 3º Bimestre 6ºs A, B e C
Lista de Atividades solicitadas no 3º Bimestre de 2020
Atividade 1 – Ginástica: atividade física x exercício físico
Data: 13/08
Entrega: 21/08
Atividade complementar (para fazer em casa)
Liste exemplos que estão presentes no seu dia a dia ou são
realizados por você:
|
Dia |
Atividade física ou exercício físico |
Duração do tempo |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
|
5 |
|
|
|
6 |
|
|
Atividade 2 – SP Faz Escola Vol 3
6ºs anos - Educação Física
PRAZO DE ENTREGA: 11/09/2020
sexta-feira
Págs. 47 e 48
Atividade 1 – Relembrando as capacidades físicas utilizadas
no handebol
Atividade 2 – Atletismo e capacidades Físicas
Essas atividades foram resolvidas nas aulas do CMSP de 06 de
agosto, podem acessar o resumo.
Como discutido na última videoaula que infelizmente teve de
ser interrompida devido a dificuldades técnicas com a internet, eu discordei da
resposta dada na atividade 2 sobre a Capacidade Física predominante no
Lançamento de Disco, na minha opinião é FORÇA e não AGILIDADE.
Essa será a única resposta que pode ser divergente.
Bons estudos galera!
Professor Alex
-
Atividade de Arte – Introdução ao Teatro 9o ano - Profa. Daniela Teatro Neste bimestre você vai conhecer a Linguagem Teatral, a estreita...
-
Atividade de Arte – Símbolos (máscaras) teatrais 6º ano - Profa. Daniela Os símbolos do Teatro Os símbolos do teatro moderno...
-
2° Ano E Biologia Profa Solange Período para entrega: Até 28/10/2020 4° Bimestre: Unidade Temática: DNA- Tecnologias de Manipulação do DN...
