3º Ano A e 3° Ano B - Biologia - Profa Solange
Período para entrega: Até 16/09/2020
Unidade Temática: Origem da Vida
Instruções:
1- Fazer a leitura e interpretação de texto.
2- Assistir as vídeo aulas (Khan Academy), links disponibilizados abaixo, digitar no Google USP Talks, assistir o vídeo sobre As Origens da Vida e do Universo.
3- Responder as questões disponibilizadas logo abaixo do texto.
4- Postar no Blogger e enviar para o e-mail da professora: solangestandbyme@gmail.com
https://youtu.be/deYpjDk_Zac
https://youtu.be/s55-f_35U8Y
https://youtu.be/SHPy2GQkuiI
https://youtu.be/o_ofGfvMLcw
https://youtu.be/J9Nn65fEhfE
USP Talks#05: As Origens da Vida e do Universo/Augusto Damineli
Número atômico, massa atômica e isótopos
Propriedades fundamentais dos átomos, incluindo número atômico e massa atômica. O número atômico é o número de prótons em uma átomo, e isótopos têm o mesmo número atômico, porém diferem no número de nêutrons.
Introdução
A radioatividade aparece com bastante frequência nos noticiários. Você já pode ter lido sobre isto em discussões acerca da energia nuclear, da tragédia do reator nuclear de Fukushima ou do desenvolvimento de armas nucleares. Ela também aparece na cultura popular: a origem de muitos dos super heróis das histórias envolve, por exemplo, sua exposição à radiação ou, no caso do Homem Aranha, uma picada de aranha radioativa. Mas o que exatamente significa ser radioativo?
A radioatividade é na verdade uma propriedade do átomo. Átomos radioativos têm núcleos instáveis que liberam partículas subatômicas para se tornarem mais estáveis, emitindo energia - radiação - durante o processo. Muitas vezes os elementos se apresentam em duas versões, radioativa e não radioativa, que diferem pelo número de nêutrons que eles contêm. Essas versões diferentes dos elementos são chamadas isótopos e os isótopos radioativos geralmente aparecem em pequena quantidade na natureza. Por exemplo, uma pequena quantidade do carbono existente na atmosfera é carbono-14 radioativo e a quantidade de carbono-14 encontrada nos fósseis permite aos paleontólogos a determinação de suas idades.
Neste artigo, veremos em mais detalhes as partículas sub atômicas que os diferentes átomos contêm e também o que faz um isótopo ser radioativo
Número atômico, massa atômica e massa atômica relativa
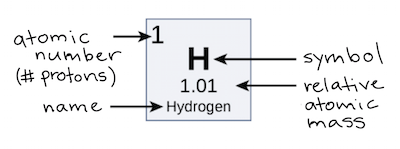
Os átomos de cada elemento contêm um número característico de prótons. O número de prótons determina qual o átomo (p.e., todos os átomos com seis prótons, são átomos de carbono); o número de prótons num átomo é chamado de número atômico. Em contraste, o número de nêutrons de um elemento pode variar. Formas do mesmo elemento que diferem apenas em seu número de nêutrons são chamadas isótopos. Juntos, o número de prótons e o número de nêutrons determinam num elemento a sua massa atômica: massa atômica = prótons + nêutrons. Se você quiser calcular quantos nêutrons tem um átomo, você deve subtrair o número de prótons, ou seja o número atômico, do número de massa daquele átomo .
Uma propriedade intimamente relacionada ao número de massa de um átomo é sua massa atômica. A massa atômica de um único átomo é sua massa total e é tipicamente expressa em unidades de massa atômica ou u. Por definição, um átomo de carbono com seis nêutrons, carbono-12, tem um número de massa de 12 u. Outros átomos geralmente não têm um número de massa atômica redondo, por razões que estão além do contexto deste artigo. Em geral, embora a massa atômica de um átomo seja muito próxima de seu número de massa, ela terá algum um desvio nas casas decimais.
Uma vez que os isótopos de um elemento têm diferentes massas atômicas, os cientistas podem determinar a massa atômica relativa—também chamada de peso atômico—de um elemento. A massa atômica relativa é a média das massas atômicas de todos os diferentes isótopos de uma amostra, na qual cada contribuição de um isótopo, é determinada pelo montante da sua contribuição para a média. A massa atômica relativa dada na tabela periódica—como a do hidrogênio, abaixo—é calculada para todos os isótopos de cada elemento, que ocorrem naturalmente, de acordo com a abundância desses isótopos na Terra. Objetos extraterrestres, como asteroides, ou meteoros podem ter abundâncias isotópicas relativas muito diferentes.
Isótopos e decaimento radioativo
Como mencionado acima, os isótopos são as diferentes formas de um elemento, eles têm o mesmo número de prótons, mas números diferentes de nêutrons. Muitos elementos — tais como o carbono, potássio e urânio — possuem vários isótopos naturais. Um átomo neutro de carbono-12 contém 6 prótons, 6 nêutrons e seis elétrons; portanto tem um número de massa de 12 (seis prótons e seis nêutrons). O carbono neutro-14 contém seis prótons, oito nêutrons seis elétrons; seu número de massa é 14 (seis prótons e oito nêutrons). Estas duas formas alternativas de carbono são isótopos.
Alguns isótopos são estáveis, mas outros podem emitir ou expulsar partículas sub atômicas para atingir uma configuração menos energética mais estável. Tais isótopos são chamados de radioisótopos, e o processo pelo qual liberam partículas e energia é conhecido como decaimento. O decaimento radioativo pode causar uma mudança no número de prótons no núcleo; quando isto acontece, a identidade do átomo muda (p.e., carbono-14 decaindo para nitrogênio-14).
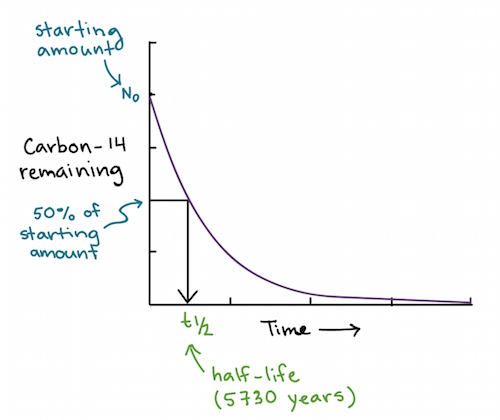
O decaimento radioativo é um processo aleatório mas exponencial, e a meia-vida de um isótopo é o período no qual metade do material decairá para um produto diferente, relativamente mais estável. A proporção do isótopo original para seu produto após o decaimento e para isótopos estáveis é previsível; essa previsibilidade permite que a abundância relativa dos isótopos seja utilizada como um relógio que mede o tempo da incorporação do isótopo (p.e., num fóssil) até o presente.
Por exemplo, o carbono está normalmente presente na atmosfera na forma de gases como dióxido de carbono e existe em três formas isotópicas: carbono-12 e carbono-13, que são estáveis, e carbono-14, que é radioativo. Essas formas de carbono são encontradas na atmosfera em proporções relativamente constantes, com carbono-12 como a principal forma com aproximadamente 99%, carbono-13 como a menor, cerca de 1%, e carbono-14 presente apenas em quantidades muito pequenas
1start superscript, 1, end superscript. Uma vez que as plantas retiram o dióxido de carbono do ar para produzir açúcares, a quantidade relativa de carbono-14 em seus tecidos é igual à concentração de carbono-14 da atmosfera. Já que os animais alimentam-se de vegetais, ou de outros animais que se alimentaram de vegetais, as concentrações de carbono-14 em seus corpos também vão se igualar à concentração atmosférica. Quando um organismo morre, ele para de absorver carbono-14, assim, a proporção de carbono-14 para carbono-12 em seus restos, tais como ossos fossilizados, vai diminuir à medida que o carbono-14 gradualmente decair para nitrogênio-14
2squared.
Após uma meia vida de aproximadamente 5.730 anos, metade do carbono-14 que estava inicialmente presente terá se convertido a nitrogênio-14. Essa propriedade pode ser utilizada para datar restos de seres vivos, como ossos antigos ou madeira. Comparando-se a razão das concentrações de carbono-14 para carbono-12 de um objeto, com a mesma razão na atmosfera, equivalente à concentração inicial no objeto, pode-se determinar a fração do isótopo que ainda não decaiu. Com base nesta fração, a idade do material pode ser calculada com precisão se ele não for muito mais antigo que 50.000 anos. Outros elementos têm isótopos com diferentes meias vidas e podem ser utilizados para avaliar a idade em diferentes escalas de tempo. Por exemplo, o potássio-40 tem meia vida de 1,25 bilhão de anos e o urânio-235 tem meia vida de cerca de 700 milhões de anos e tem sido utilizado para avaliar a idade das rochas lunares
2squared.
Créditos:
Este artigo foi produzido com base nos seguintes dois artigos:
Referências:
Reece, J. B., L. A. Urry, M. L. Cain, S. A. Wasserman, P. V. Minorsky, and R. B. Jackson. "Calibrating a Standard Radioactive Isotope Decay Curve and Interpreting Data." In Campbell Biology, 28-43. 10th ed. San Francisco, CA: Pearson, 2011.
Outras referências
Raven, P. H., G. B. Johnson, K. A. Mason, J. B. Losos, and S. R. Singer. "The Nature of Molecules and Properties of Water." In Biology, 17-30. 10th ed. AP Edition. New York, NY: McGraw-Hill, 2014.
Reece, J. B., L. A. Urry, M. L. Cain, S. A. Wasserman, P. V. Minorsky, and R. B. Jackson. "The Chemical Context of Life." In Campbell Biology, 28-43. 10th ed. San Francisco, CA: Pearson, 2011.
Exercícios de Aprendizagem:
1- Analise as alternativas abaixo e marque aquela que indica corretamente o nome da teoria que defende que a vida surgiu no planeta a partir de organismos provenientes de outras partes do universo.
a) Abiogênese.
b) Geração espontânea.
c) Evolução química.
d) Panspermia.
e) Seleção natural.
2- A origem da vida é explicada por diferentes teorias. Em uma delas, sugere-se que a vida surgiu devido à presença de gases na atmosfera que sofreram a ação de descargas elétricas e radiações, fazendo com que moléculas inorgânicas dessem origem a moléculas orgânicas. Essa ideia é conhecida como
a) Abiogênese.
b) Geração espontânea.
c) Evolução química.
d) Panspermia.
e) Seleção natural.
3- A origem da vida sempre foi motivo de muita pesquisa e dúvidas. Inicialmente, acreditava-se que a vida surgia a partir de matéria inanimada, uma teoria conhecida como
a) Biogênese.
b) Geração espontânea.
c) Evolução química.
d) Evolução molecular.
e) Seleção natural.
4- (Unicentro) São muitas as discussões sobre a origem da vida no planeta Terra. Os estudos sobre o assunto evidenciam a importância dos avanços tecnológicos e das pesquisas para o aprimoramento das hipóteses sobre a origem da vida. Porém, após alguns séculos de estudos, apesar de consideráveis avanços, ainda existem muitas perguntas sem respostas. Sobre as principais teorias da origem da vida, pode-se afirmar:
a) Haldane e Oparin admitiam que moléculas inorgânicas, encontradas na atmosfera primitiva, se combinariam originando moléculas orgânicas simples, que, posteriormente, adquiriram a capacidade de autoduplicação e metabolismo.
b) A teoria da abiogênese foi confirmada com as pesquisas realizadas por Pasteur, em que micro-organismos foram encontrados em frascos com “pescoço de cisne”, após o processo de fervura.
c) Os avanços tecnológicos e as pesquisas atuais permitiram definir a descoberta da vida como sendo através da evolução de componentes inorgânicos originados no próprio planeta Terra.
d) Segundo a panspermia, os primeiros seres vivos teriam vindo do cosmos e seriam pluricelulares e autótrofos.
e) As pesquisas realizadas puderam comprovar a hipótese autotrófica, pois não existiam nutrientes suficientes na Terra primitiva para suprir os seres vivos.
5- (UCPel) O aglomerado de moléculas orgânicas, revestido por uma película de moléculas de água e que, na opinião de alguns cientistas, pode ser um dos primeiros passos rumo à origem da vida, chama-se:
a) Aminoácido.
b) Coacervado.
c) Micro-organismo.
d) Enzima.
d) Proteína.
Nenhum comentário:
Postar um comentário